
1. ¿Qué es una enzima?
Son proteínas que disminuyen la cantidad de energía que se requiere para llevar a cabo una reacción; esta actividad catálitica es específica.
Son proteínas especializadas en la catálisis de las reacciones biológicas.
Son proteínas especializadas en la catálisis de las reacciones biológicas.
2. ¿Cómo se clasifica las enzimas?
Se clasifican de acuerdo con el tipo de reacción catalizada, dividida en 6 clases principales:
1. Óxido-reductasas ( Reacciones de oxido-reducción)
Son las enzimas relacionadas con las oxidaciones y las reducciones biológicas que intervienen de modo fundamental en los procesos de respiración y fermentación. Las oxidoreductasas son importantes a nivel de algunas cadenas metabólicas, como la escisión enzimática de la glucosa, fabricando el ATP, verdadero almacén de energía. Extrayendo dos átomos de hidrógeno, catalizan las oxidaciones de muchas moléculas orgánicas presentes en el protoplasma; los átomos de hidrógeno tomados del sustrato son cedidos a algún captor. En esta clase se encuentran las siguientes subclases principales: Deshidrogenasas y oxidasas. Son más de un centenar de enzimas en cuyos sistemas actúan como donadores, alcoholes, oxácidos aldehidos, cetonas, aminoácidos, DPNH2, TPNH2, y muchos otros compuestos y, como receptores, las propias coenzimas DPN y TPN, citocromos, O2, etc.
2.Las Transferasas
Estas enzimas catalizan la transferencia de una parte de la molécula (dadora) a otra (aceptora). Su clasificación se basa en la naturaleza química del sustrato y en la del aceptor. También este grupo de enzimas actúan sobre los sustratos mas diversos, transfiriendo grupos metilo, aldehído, glucosilo, amina, sulfató, sulfúrico, etc.
3.Las Hidrolasas
Esta clase de enzimas actúan normalmente sobre las grandes moléculas del protoplasma, como son la de glucógeno, las grasas y las proteínas. La acción catalítica se expresa en los enlaces entre átomos de carbono y nitrógeno (C-N) o carbono oxigeno (C-O); simultáneamente se obtiene la hidrólisis. El hidrógeno y el oxidrilo resultantes de la hidrólisis se unen respectivamente a las dos moléculas obtenidas por la ruptura de los mencionados enlaces. La clasificación de estas enzimas se realiza en función del tipo de enlace químico sobre el que actúan. A este grupo pertenecen proteínas muy conocidas: la pepsina, presente en el jugo gástrico, y la tripsina y la quimiotripsina, segregada por el páncreas. Desempeñan un papel esencial en los procesos digestivos, puesto que hidrolizan enlaces pépticos, estéricos y glucosídicos.
4.Las isomerasas
Transforman ciertas sustancias en otras isómeras, es decir, de idéntica formula pero con distinto desarrollo. Son las enzimas que catalizan diversos tipos de isomerización. Se dividen en varias subclases. Las racemasas y las epimerasas actúan en la racemización de los aminoácidos y en la epimerización de los azúcares. Las primeras son en realidad pares de enzimas específicas para los dos isómeros y que producen un solo producto común.
Las isomerasas cis – trans modifican la configuración geométrica a nivel de un doble ligadura. Los óxidos – reductasas intramoleculares catalizan la interconversión de aldosas y cetosas, oxidando un grupo CHOH y reduciendo al mismo tiempo al C = O, como en el caso de la triosa fosfato isomerasa, presente en el proceso de la glucólisis; en otros casos cambian de lugar dobles ligaduras
Transforman ciertas sustancias en otras isómeras, es decir, de idéntica formula pero con distinto desarrollo. Son las enzimas que catalizan diversos tipos de isomerización. Se dividen en varias subclases. Las racemasas y las epimerasas actúan en la racemización de los aminoácidos y en la epimerización de los azúcares. Las primeras son en realidad pares de enzimas específicas para los dos isómeros y que producen un solo producto común.
Las isomerasas cis – trans modifican la configuración geométrica a nivel de un doble ligadura. Los óxidos – reductasas intramoleculares catalizan la interconversión de aldosas y cetosas, oxidando un grupo CHOH y reduciendo al mismo tiempo al C = O, como en el caso de la triosa fosfato isomerasa, presente en el proceso de la glucólisis; en otros casos cambian de lugar dobles ligaduras
Las transferasas intramoleculares (o mutasas) pueden facilitar el traspaso de grupos acilo, o fosforilo de una parte a otra de la molécula, como la lisolecitina que transforma la 2 – lisolecitina en 3 – lisolecitina, etc. Algunas isomerasa actúan realizando inversiones muy complejas, como transformar compuestos aldehídos en compuestos cetona, o viceversa. Estas ultimas desarrollan una oxidorreducción dentro de la propia molécula (oxido reductasa intramoleculares) sobre la que actúan, quitando hidrógeno, a algunos grupos y reduciendo otros; actúan ampliamente sobre los aminoácidos, los hidroxácidos, hidratos de carbono y sus derivados.
5.Las Liasas
Estas enzimas raramente construyen enlaces entre átomos de carbono, o bien entre carbono y oxigeno, carbono y nitrógeno, y carbono y azufre. Los grupos separados de las moléculas que de sustrato son casi el agua, el anhídrido carbónico, y el amoniaco. Algunas liasa actúan sobre compuestos orgánicos fosforados muy tóxicos; otros separan el carbono de numerosos sustratos.
6. Las Ligasas
Es un grupo de enzimas que permite la unión de dos moléculas, lo cual sucede simultáneamente a la degradación del ATP, que, en rigor, libera la energía necesaria para llevar a cabo la unión de las primeras. Se trata de un grupo de enzimas muy importantes y recién conocidas, pues antes se pensaba que este efecto se llevaba a cabo por la acción conjunta de dos enzimas, una fosfocinasa, para fosforilar a una sustancia y una transferasa que pasaría y uniría una sustancia con otra. A este grupo pertenecen enzimas de gran relevancia, como las aminoácido –ARNt ligasas conocidas habitualmente con el nombre de sintetasas de aminoácidos –ARNt o enzimas activadoras de aminoácidos que representan el primer paso en el proceso biosintético de las proteínas, y que forman uniones C-O; las ácido-tiol ligasas, un ejemplo típico de las cuales es la acetil coenzima. A sintetasa, que forma acetil coenzima. A partir de ácido acético y coenzima A ; las ligasas ácido – amoniaco (glutamina sintetasa), y las ligasas ácido-aminoácido o sintetasas de péptidos, algunos de cuyos ejemplos más conocidos son la glutación sintetasa, la carnosina sintetasa, etc.
Estas enzimas raramente construyen enlaces entre átomos de carbono, o bien entre carbono y oxigeno, carbono y nitrógeno, y carbono y azufre. Los grupos separados de las moléculas que de sustrato son casi el agua, el anhídrido carbónico, y el amoniaco. Algunas liasa actúan sobre compuestos orgánicos fosforados muy tóxicos; otros separan el carbono de numerosos sustratos.
6. Las Ligasas
Es un grupo de enzimas que permite la unión de dos moléculas, lo cual sucede simultáneamente a la degradación del ATP, que, en rigor, libera la energía necesaria para llevar a cabo la unión de las primeras. Se trata de un grupo de enzimas muy importantes y recién conocidas, pues antes se pensaba que este efecto se llevaba a cabo por la acción conjunta de dos enzimas, una fosfocinasa, para fosforilar a una sustancia y una transferasa que pasaría y uniría una sustancia con otra. A este grupo pertenecen enzimas de gran relevancia, como las aminoácido –ARNt ligasas conocidas habitualmente con el nombre de sintetasas de aminoácidos –ARNt o enzimas activadoras de aminoácidos que representan el primer paso en el proceso biosintético de las proteínas, y que forman uniones C-O; las ácido-tiol ligasas, un ejemplo típico de las cuales es la acetil coenzima. A sintetasa, que forma acetil coenzima. A partir de ácido acético y coenzima A ; las ligasas ácido – amoniaco (glutamina sintetasa), y las ligasas ácido-aminoácido o sintetasas de péptidos, algunos de cuyos ejemplos más conocidos son la glutación sintetasa, la carnosina sintetasa, etc.
3. ¿Cómo actúa una enzima?
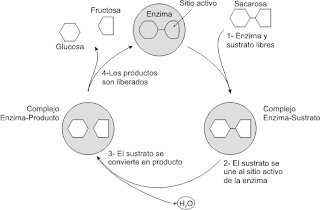 La acción enzimática se caracteriza por la formación de un complejo que representa el estado de transición. El sustrato se une al enzima a través de numerosas interacciones débiles como son: puentes de hidrógeno, electrostáticas, hidrófobas, etc, en un lugar específico , el centro activo. Este centro es una pequeña porción del enzima, constituido por una serie de aminoácidos que interaccionan con el sustrato. Con su acción, regulan la velocidad de muchas reacciones químicas implicadas en este proceso.
La acción enzimática se caracteriza por la formación de un complejo que representa el estado de transición. El sustrato se une al enzima a través de numerosas interacciones débiles como son: puentes de hidrógeno, electrostáticas, hidrófobas, etc, en un lugar específico , el centro activo. Este centro es una pequeña porción del enzima, constituido por una serie de aminoácidos que interaccionan con el sustrato. Con su acción, regulan la velocidad de muchas reacciones químicas implicadas en este proceso. Parte de la proteína que es cataliticamente inactiva.
5. ¿Qué es una coenzima?
Es una pequeña molécula orgánica que se une a una enzima y que es esencial para su actividad, pero que no sufre una alteración permanente en la reacción. La mayor parte de las coenzimas derivan de las vitaminas y cada tipo de coenzima tiene una función bioquímica concreta. Algunas son agentes de oxidorreducción, otras facilitan la transferencia de grupos, entre otras actividades bioquímicas. Por lo tanto, las coenzimas son la forma activa de las vitaminas, como por ejemplo, la forma activa o coenzimática de la tiamina es el pirofosfato de tiamina (PPT), siempre y cuando la célula produzca ATP y pueda fosforilar a la vitamina para convertirla en coenzima (su forma activa).
6.¿Qué es cinética enzimática?
Estudia la velocidad de las reacciones químicas que son catalizadas por las enzimas. El estudio de la cinética de una enzima permite explicar los detalles de su mecanismo catalítico, su papel en el metabolismo, cómo es controlada su actividad en la célula y cómo puede ser inhibida su actividad por fármacos o venenos o potenciada por otro tipo de moléculas.



No hay comentarios:
Publicar un comentario